Penerapan Aturan Faraday Pada Reaksi Sel Elektrolisis
Hukum Faraday Pada Reaksi Sel Elektrolisis
Michael Faraday pakar Kimia-Fisika Inggris. Faraday menyatakan bahwa sel elektrolisis sanggup dipakai untuk memilih banyaknya zat yang bereaksi menurut jumlah muatan listrik yang dipakai dalam rentang waktu tertentu.
a. Hukum I Faraday
Dalam sel volta maupun sel elektrolisis terdapat hubungan kuantitatif antara jumlah zat yang bereaksi dan muatan listrik yang terlibat dalam reaksi redoks. Pernyataan ini merupakan prinsip dasar Hukum Faraday, yaitu:
1. Jumlah zat yang dihasilkan di electrode pada kejadian elektrolisis sebanding dengan besarnya muatan listrik (aliran elektron) yang dialirkan selama elektrolisis berlangsung.
2. Massa ekuivalen zat yang diendapkan pada elektrode akan setara kalau muatan listrik yang dialirkan ke dalam sel sama.
Aliran listrik ialah ajaran elektron. Oleh sebab itu, muatan listrik yang terlibat dalam sel elektrokimia sanggup ditentukan menurut muatan electron pada reaksi redoks pada sel elektrokimia.Menurut Millikan muatan elektron: e = 1,60217733 × 10–19C.
Misal di dalam sel elktrolisis di katode terjadi reduksi terhadap ion logam Ag+ seperti reaksi Ag+ + e à Ag
Berdasarkan reaksi tsb, untuk mereduksi 1 mol ion Ag+ menjadi logam perak Ag dibutuhkan 1 mol electron. Jika muatan listrik setiap electron = 1,602 × 10–19C dan 1 mol electron = 6,02 x 1023 buah electron, maka muatan satu mol electron
q =1,602 ×10–19 x 6,02 x 1023
= 96.487 C ≈ 96.500 Coulomb.
Muatan listrik yang setara dengan 1 mol electron disebut 1 Faraday ( 1 F ).
Jadi 1 F = 96.500 C = 1 mol electron
Keterangan:
w = massa zat (g)
e = massa ekuivalen atau Mr/valensi
i = besar lengan berkuasa arus (A)
t = waktu (s)
F =tetapan Faraday = 96.500 coulomb
1 F = 1 mol elektron
Untuk 2 elektrolit atau lebih yang dielektrolisis dengan jumlah arus yang sama berlaku
b. Hukum II Faraday
Jika arus listrik yang sama dialirkan ke dalam beberapa sel elektrolisis maka jumlah zat yang dihasilkan pada masing-masing elektrodenya sebanding dengan massa ekuivalen masing-masing zat tersebut.
Keterangan:
wA = massa zat A wB = massa zat B
eA = massa ekuivalen zat A eB = massa ekuivalen zat B
Contoh soal Sel Elektrolisis dan Hukum Faraday
Soal No 1
Berapakah massa tembaga yang diendapkan di katode pada elektrolisis larutan CuSO4dengan memakai arus 2 A selama 20 menit. (Ar Cu = 63,5 g/mol)
Jawab
Di katode, terjadi reaksi reduksi Cu2+(aq) + 2 e– à Cu(s)
t = 20 menit = 1.200 s
e = Ar/ valensi = 63,5/ 2 = 31,75
w = (eit)/96.500 = ( 31,75 x 2 x 1200 )/ 96500 = 0,79 gram
Jadi, massa tembaga yang diendapkan pada katode ialah 0,79 g.
Soal No 2
Ke dalam 500 ml larutan CuSO4 0,1 M dilewatkan arus sebesar 0,02 F.
a. Tulis reaksi elektrolisisnya
b. Hitung volume oksigen (STP) yang dihasilkan di anode
c. Hitung pH larutan setelah elektrolisis
Jawab
a. Reaksi elektrolisisnya
Katode Cu2+ + 2e à Cu
Anode 2H2O à O2 + 4H+ + 4e
b. mol electron = 0,2 F = 0,02 mol
mol O2 di anode = 1/4 x 0,02 mol = 0,005 mol
Volume O2 (STP) = 0,005 x 22,4 liter
= 0,112 liter
c. pH berkaitan dengan ion H+. Jadi hitung mol H+ pada anode
4/4 x 0,02 mol = 0.02 mol
Bila volume dianggap tak berubah : 200 ml atau 0,2 liter
maka (H+) = 0.02 mol/ 0,2 l = 0,1 M
pH = 1.
Soal No 3
Arus listrik sebesar 965 mA dialirkan melalui suatu larutan asam selama 5 menit. Banyaknya gas hidrogen yang terbentuk adalah....
A. 3,0 × 10−3 mol
B. 2,5 × 10−3 mol
C. 2,0 × 10−3 mol
D. 1,5 × 10−3 mol
E. 1,0 × 10−3 mol
Pembahasan
Gas hidrogen yang terbentuk berasal dari reduksi ion H+ dengan reaksinya sebagai berikut: 2H+ + 2e → H2
Terlebih dulu memilih jumlah mol elektronnya
dengan data:Arus listrik sebesar 965 mA dialirkan melalui suatu larutan asam selama 5 menit. Banyaknya gas hidrogen yang terbentuk adalah....
A. 3,0 × 10−3 mol
B. 2,5 × 10−3 mol
C. 2,0 × 10−3 mol
D. 1,5 × 10−3 mol
E. 1,0 × 10−3 mol
Pembahasan
Gas hidrogen yang terbentuk berasal dari reduksi ion H+ dengan reaksinya sebagai berikut: 2H+ + 2e → H2
Terlebih dulu memilih jumlah mol elektronnya
i = 965 mA = 0,965 A
t = 5 menit = 300 sekon
diperoleh jumlah mol elektronnya
Berikutnya, memilih jumlah mol gas H2 yang terbentuk
Soal No. 4
Proses elektrolisis lelehan NaCl dengan elektroda karbon, dipakai arus sebesar 10 ampere selama 30 menit. Massa logam natrium yang diperoleh adalah....(Ar Na = 23; Cl = 35,5)
A. (23 × 10 × 30 × 60) / (96500)
B. (23 × 10 × 30) / (96500)
C. (58,5 × 10 × 30 × 60) / (96500)
D. (58,5 × 10 × 30) / (96500)
E. (58,8 × 10 × 30 × 60) / (2 × 96500)
Pembahasan
Elektrolisis lelehan NaCl dengan elektroda karbon.
Data soal:
i = 10 A
t = 30 menit = 30 × 60 detik
m Na =................
Dengan memakai aplikasi aturan Faraday
dimana e ialah massa ekivalen, i ialah besar lengan berkuasa arus dan t ialah waktu dalam sekon. Massa ekivalen dari Na adalahElektrolisis lelehan NaCl dengan elektroda karbon.
Data soal:
i = 10 A
t = 30 menit = 30 × 60 detik
m Na =................
Dengan memakai aplikasi aturan Faraday
e = Ar / biloks = 23 / 1 = 23
sehingga massa logam natrium yang diperoleh adalah
Jawaban: Asehingga massa logam natrium yang diperoleh adalah
Soal No 5
Arus listrik 0,2 ampere dilewatkan selama 50 menit ke dalam sel elektrolisis yang mengandung larutan CuCl2. Hitunglah endapan Cu yang terbentuk pada katode. (Ar Cu=63,5)
Pembahasan
Hitung endapan Cu, wCu, memakai rumus:
wCu = (1/96.500) x I x t x MECu = dimana ME = Ar/biloks
Diketahui:
Arus, I = 0,2 A;
Waktu, t = 50 menit = 50 x 60 detik = 3.000 detik
Cari nilai MECu dengan menuliskan reaksi reduksi Cu:
Cu2+(aq) + 2e– → Cu(s) ; MECu = Ar/biloks = 63,5/2 = 31,75
Jadi, diperoleh:
WCu = (1/96.500) x 0,2 A x 3.000 detik x 31,75 = 0,197 g.
Soal No. 6
Larutan ZnSO4 dielektrolisis dengan arus listrik 5 ampere selama 10 menit. Bila Ar Zn = 65, endapan Zn yang terbentuk di katoda sebanyak....
A. 0,84 gram
B. 1,01 gram
C. 1,68 gram
D. 2,02 gram
E. 2,34 gram
Pembahasan
Elektrolisis larutan ZnSO4.
Data:
i = 5 A
t = 10 menit = 600 sekon
Ar Zn = 65
m =............
massa ekivalen dari Zn
e = 65 / 2 = 32,5
sehingga massa yang diperoleh adalah

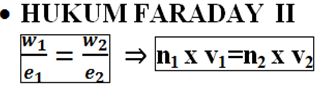







0 Response to "Penerapan Aturan Faraday Pada Reaksi Sel Elektrolisis"
Post a Comment