Penjelasan Mengenai Hukum-Hukum Wacana Gas
Pada pembahasan kali ini kita akan mempelajari Hukum-hukum yang berkaitan ihwal Gas, diantara hukum-hukum tersabut adalah, Hukum Boyle, Hukum Charles, Hukum Gay Lussac, Hukum Boyle-Gay Lussac, Persamaan Umum Gas Ideal, untuk lebih jelasnya silahkan anda perhatikan klarifikasi berikut:
1. Hukum Boyle
Volume gas dalam suatu ruang tertutup sangat bergantung pada tekanan dan suhunya. Apabila suhu dijaga konstan, maka tekanan yang diberikan akan memperkecil volumenya. Hubungan, tersebut dikenal dengan Hukum Boyle yang sanggup dinyatakan berikut ini.
“Apabila suhu gas yang berada dalam ruang tertutup dijaga konstan, maka tekanan gas berbanding terbalik dengan volumenya”.
Secara sistematis, pernyataan tersebut sanggup dituliskan:
P ∞ 1/V, untuk P.V = konstan atau:
P 1 .V 1 = P 2 .V 2
(1)
dengan:
P 1 = tekanan gas pada keadaan 1 (N/m 2 )
V 1 = volume gas pada keadaan 1 (m 3 )
P 2 = tekanan gas pada keadaan 2 (N/m 2 )
V 2 = volume gas pada keadaan 2 (m 3 )
Persamaan (1) menyatakan bahwa pada suhu konstan, bila tekanan atau volume gas berubah, maka variabel yang lain juga berubah sehingga hasil kali P.V selalu tetap.
Hubungan antara tekanan dan volume gas pada suhu konstan sanggup dilukiskan dengan grafik ibarat yang tampak pada Gambar berikut:
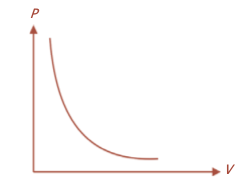
Grafik kekerabatan P -V pada suhu konstan.
Grafik tersebut mengatakan bahwa pada dikala volumenya bertambah, tekanan gas akan berkurang. Proses pada suhu konstan disebut proses isotermis.
2. Hukum Charles
Telah diketahui bahwa selain ditentukan oleh tekanan, volume gas dalam ruang tertutup juga dipengaruhi oleh suhu. Jika suhu gas dinaikkan, maka gerak partikel-partikel gas akan semakin cepat sehingga volumenya bertambah. Apabila tekanan tidak terlalu tinggi dan dijaga konstan, volume gas akan bertambah terhadap kenaikan suhu. Hubungan tersebut dikenal dengan Hukum Charles yang sanggup dinyatakan berikut ini.
“Apabila tekanan gas yang berada dalam ruang tertutup dijaga konstan, maka volume gas berbanding lurus dengan suhu mutlaknya.”
Secara matematis, pernyataan tersebut sanggup dituliskan:
V ∞ T
(2)
dengan:
V 1 = volume gas pada keadaan 1 (m 3 )
T 1 = suhu mutlak gas pada keadaan 1 (K)
V 2 = volume gas pada keadaan 2 (m 3 )
T 2 = suhu mutlak gas pada keadaan 2 (K)
Hubungan antara volume gas dan suhu pada tekanan konstan sanggup dilukiskan dengan grafik ibarat yang tampak pada Gambar berikut:

Grafik kekerabatan V -T pada tekanan konstan.
Proses yang terjadi pada tekanan tetap disebut proses isobaris.
3. Hukum Gay Lussac
Apabila botol dalam keadaan tertutup kita masukkan ke api, maka botol tersebut akan meledak. Hal ini terjadi sebab naiknya tekanan gas di dalamnya akhir kenaikan suhu. Dengan demikian, sanggup dikatakan bahwa:
“Apabila volume gas yang berada pada ruang tertutup dijaga konstan, maka tekanan gas berbanding lurus dengan suhu mutlaknya”.
Pernyataan tersebut dikenal dengan Hukum Gay Lussac. Secara matematis sanggup dituliskan:
P ∞ T
(3)
dengan:
P 1 = tekanan gas pada keadaan 1 (N/m 2 )
T 1 = suhu mutlak gas pada keadaan 1 (K)
P 2 = tekanan gas pada keadaan 2 (N/m 2 )
T 2 = suhu mutlak gas pada keadaan 2 (K)
Hubungan antara tekanan dan suhu gas pada volume konstan sanggup dilukiskan dengan grafik ibarat yang tampak pada Gambar berikut:
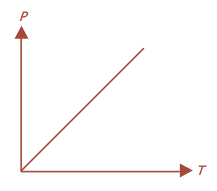
Grafik kekerabatan P -T pada volume konstan
Proses yang terjadi pada volume konstan disebut proses isokhoris.
4. Hukum Boyle-Gay Lussac
Hukum Boyle-Gay Lussac merupakan adonan dari persamaan (1), (2), dan (3), sehingga sanggup dituliskan:
PV/T = konstan
(4)
5. Persamaan Umum Gas Ideal
Sebelum membahas lebih lanjut mengenai persamaan umum gas ideal, kita akan mendefinisikan dahulu beberapa istilah kimia yang berkaitan dengan gas ideal.
- Massa atom relatif (Ar), yaitu perbandingan massa rata-rata sebuah atom suatu unsur terhadap 1/12 kali massa sebuah atom 126C . Harga massa atom relatif bukanlah massa yang bahwasanya dari suatu atom, tetapi hanya merupakan harga perbandingan.Contoh:Ar H = 1Ar Ne = 20Ar Ar = 4
- Massa molekul relatif (Mr), yaitu jumlah keseluruhan massa atom relatif (Ar) unsur-unsur penyusun senyawa.
- Mol (n), yaitu satuan banyaknya partikel yang besarnya merupakan hasil bagi massa suatu unsur (senyawa) dengan massa relatifnya (Ar atau Mr).
- Bilangan Avogadro, yaitu bilangan yang menyatakan jumlah partikel dalam satu mol.N A = 6,023 x 10 23 partikel/molN = n NAN yaitu jumlah total partikel.
Hukum-hukum ihwal gas dari Boyle, Charles, Gay Lussac, dan Boyle-Gay Lussac diperoleh dengan menjaga satu atau lebih variabel dalam keadaan konstan untuk mengetahui akhir dari perubahan satu variabel. Berdasarkan Hukum Boyle–Gay Lussac diperoleh:
PV/T = konstan atau PV/T = k
Apabila jumlah partikel berubah, maka volume gas juga akan berubah. Hal ini berarti bahwa harga PV/T yaitu tetap, bergantung pada banyaknya partikel (N ) yang terkandung dalam gas. Persamaan di atas sanggup dituliskan:
PV/T = N . k
P . V = N . k . T
(i)
k = konstanta Boltzmann, (k = 1,38 x 10-23 J/K)
Karena N = n.NA , maka:
P.V = n.NA .k.T
(ii)
NA .k = R, yang merupakan konstanta gas umum yang besarnya sama untuk semua gas, maka persamaan (ii) menjadi:
P.V = n.R.T
(5)
dengan:
P = tekanan gas (N/m2)
V = volume gas (m3)
n = jumlah mol
T = suhu mutlak (K)
R = konstanta gas umum (J/mol.K)
R = N A .k
R = (6,023 x 1023) (1,38 x 10 -23 )
R = 8,31 J/mol.K = 0,082 L.atm/mol.K
Persamaan (5) disebut persamaan umum gas ideal.
0 Response to "Penjelasan Mengenai Hukum-Hukum Wacana Gas"
Post a Comment