Teori Atom Bohr : 4 Postulat Yang Mendasarinya Beserta Kelemahannya
Teori Atom Bohr - Sebagaimana telah Anda ketahui, teori atom Bohr didasarkan pada empat postulat sebagai berikut.
a. Elektron-elektron dalam mengelilingi inti atom berada pada tingkat- tingkat energi atau orbit tertentu. Tingkat-tingkat energi ini dilambangkan dengan n=1, n=2, n=3, dan seterusnya. Bilangan bundar ini dinamakan bilangan kuantum (perhatikan gambar dibawah!)
b. Selama elektron berada pada tingkat energi tertentu, contohnya n=1, energi elektron tetap. Artinya, tidak ada energi yang diemisikan (dipancarkan) maupun diserap.
c. Elektron sanggup beralih dari satu tingkat energi ke tingkat energi lain disertai perubahan energi. Besarnya perubahan energi sesuai dengan persamaan Planck, ∆E=hv.
d. Tingkat energi elektron yang dibolehkan mempunyai momentum sudut tertentu. Besar momentum sudut ini merupakan kelipatan dari  atau
atau  , n ialah bilangan kuantum dan h tetapan Planck.
, n ialah bilangan kuantum dan h tetapan Planck.
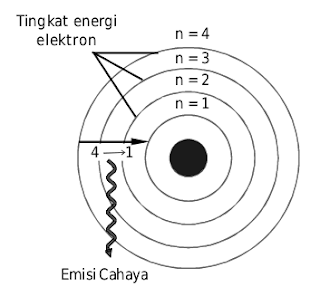
Menurut Bohr, elektron berada pada tingkat energi tertentu. Jika elektron turun ke tingkat energi yang lebih rendah, akan disertai emisi cahaya dengan spketrum yang khas.
a. Peralihan Antartingkat Energi
Model atom Bohr sanggup menunjukan spektrum atom hidrogen secara memuaskan. Menurut Bohr, cahaya akan diserap atau diemisikan dengan frekuensi tertentu (sesuai persamaan Planck) melalui peralihan elektron dari satu tingkat energi ke tingkat energi yang lain. Jika atom hidrogen menyerap energi dalam bentuk cahaya maka elektron akan beralih ke tingkat energi yang lebih tinggi. Sebaliknya, jikalau atom hidrogen mengemisikan cahaya maka elektron akan beralih ke tingkat energi yang lebih rendah.
Pada keadaan stabil, atom hidrogen mempunyai energi terendah, yakni elektron berada pada tingkat energi dasar (n=1). Jika elektron menghuni n>1, dinamakan keadaan tereksitasi. Keadaan tereksitasi ini tidak stabil dan terjadi jikalau atom hidrogen menyerap sejumlah energi. Atom hidrogen pada keadaan tereksitasi tidak stabil sehingga energi yang diserap akan diemisikan kembali menghasilkan garis-garis spektrum (perhatikan Gambar berikut!).
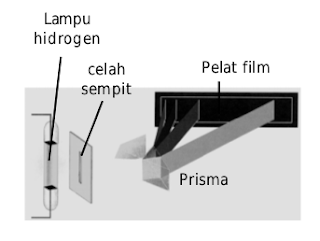
Lampu hidrogen dialiri listrik sampai menyala. Cahaya dari nyala lampu dilewatkan kepada prisma melalui celah menghasilkan spektrum garis yang sanggup dideteksi dengan pelat film.
Kemudian, elektron akan turun ke tingkat energi yang lebih rendah. Nilai energi yang diserap atau diemisikan dalam transisi elektron bergantung pada transisi antartingkat energi elektron. Persamaannya dirumuskan sebagai berikut.
b. Kelemahan Model Atom Bohr
Gagasan Bohr perihal pergerakan elektron mengitari inti atom menyerupai sistem tata surya menciptakan teori atom Bohr gampang dipahami dan sanggup diterima pada waktu itu. Akan tetapi, teori atom Bohr mempunyai beberapa kelemahan, di antaranya sebagai berikut.
- Jika atom ditempatkan dalam medan magnet maka akan terbentuk spektrum emisi yang rumit. Gejala ini disebut imbas Zeeman (perhatikan Gambar dibawah).
- Jika atom ditempatkan dalam medan listrik maka akan menghasilkan spektrum halus yang rumit. Gejala ini disebut imbas Strack.
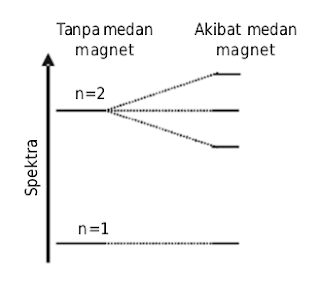
Spektrum atom hidrogen terurai dalam medan magnet (efek Zeeman).
Pakar fisika Jerman, Sommerfeld menyarankan, disamping orbit berbentuk lingkaran juga harus meliputi orbit berbentuk elips. Hasilnya, imbas Zeeman sanggup dijelaskan dengan model tersebut, tetapi model atom Bohr-Sommerfeld tidak bisa menjelaskan spektrum dari atom berelektron banyak.
Sepuluh tahun sesudah teori Bohr lahir, muncul gagasan de Broglie perihal dualisme materi, disusul Heisenberg perihal ketidakpastian posisi dan momentum partikel. Berdasarkan gagasan tersebut dan teori kuantum dari Planck, Schrodinger berhasil meletakkan dasar-dasar teori atom terkini, dinamakan teori atom mekanika kuantum.
0 Response to "Teori Atom Bohr : 4 Postulat Yang Mendasarinya Beserta Kelemahannya"
Post a Comment