Penjelasan Ihwal Teori Domain Elektron
Telah diketahui bahwa atom diikat oleh atom lain dalam suatu molekul dengan memakai pasangan-pasangan elektron yang berada di atom pusat. Pasangan-pasangan ini mengalami gaya elektrostatis tanggapan dari muatan yang dimilikinya. Berdasarkan hal tersebut, pada tahun 1970, R.G. Gillesepie mengajukan teori VSEPR (Valance Shell Elektron Pair Repulsion) yang menyatakan bahwa:
“pasangan-pasangan elektron akan berusaha saling menjauhi sehingga tolak-menolak antara pasangan elektron menjadi minimum”
Teori ini juga dikenal sebagai teori jumlah pasangan elektron.
Menurut teori VSEPR, bentuk molekul sanggup diramalkan dari jumlah pasangan elektron valensi atom pusat, dan juga posisi pasangan elektron tersebut dalam atom pusat. Di atom sentra pasangan elektron ada pada aneka macam posisi, yaitu pasangan elektron bebas-elektron bebas, pasangan elektron bebas-elektron terikat atau pasangan elektron terikat-elektron terikat. Masing-masing pasangan elektron bebas mempunyai energi tolakan yang berbeda-beda. Energi tolakan elektron bebas-elektron bebas lebih besar dibandingkan dengan energi tolakan elektron bebas-elektron terikat. Energi tolakan elektron bebas-elektron terikat akan lebih besar dibandingkan dengan energi tolakan elektron terikat-elektron terikat.
Pasangan elektron bebas-elektron bebas > elektron bebas- elektron terikat> elektron terikat-elektron terikat.
1. Perbandingan energi tolakan pasangan elektron
Pada perkembangan lebih lanjut, pengertian domain elektron tidak hanya berlaku untuk ikatan rangkap tetapi termasuk ikatan tunggal. Jika jumlah elektron dalam domain elektron semakin banyak, maka gaya tolak-menolaknya akan semakin besar. Berdasarkan jumlah atomnya, maka urutan gaya tolak-menolak pada domain elektron ikatan ialah sebagai berikut.
Domain elektron ikatan rangkap 3 lebih besar dari domain elektron ikatan rangkap 2, sedangkan domain elektron ikatan 2 lebih besar dibandingkan elektron ikatan tunggal
Berdasarkan kenyataan tersebut sanggup diramalkan bentuk molekul dari beberapa senyawa sebagaimana dalam Tabel berikut.
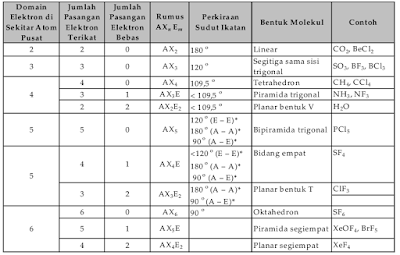
Bentuk molekul menurut teori domain elektron.
Catatan :
AXm En = rumus bentuk molekul, dengan
A : atom sentra
X : semua atom yang terikat pada atom sentra
E : domain elektron bebas
m : jumlah domain elektron ikatan (DEI)
n : jumlah domain elektron bebas (DEB)
A* = aksial
E* = ekuatorial
Cara meramalkan bentuk molekul suatu senyawa menurut teori domain elektron sebagai berikut.
- Tulis struktur Lewis-nya.
- Tentukan jumlah domain elektron di sekitar atom pusat, jumlah domain elektron ikatan (DEI) dan jumlah domain elektron bebas (DEB) dari struktur Lewis.
- Tentukan rumus bentuk molekulnya.
- Bandingkan dengan Tabel diatas
2. Teori hibridisasi
Masih ingatkah kalian konfigurasi elektron atom C? Konfigurasi elektron atom C ialah 1s2 2s2 2p2 dan jikalau dijabarkan satu-satu diperoleh C : 1s2 2s2 2px1 2py1 2pz0 . Elektron valensi terluar ialah 2, maka atom C seharusnya mengikat 2 atom H menjadi CH2 . Kenyataannya di alam senyawa CH2 tidak ada. Senyawa yang ada di alam ialah senyawa metana dengan rumus molekul CH4 , mengapa hal itu sanggup terjadi?
Berdasarkan kenyataan yang ada terbukti bahwa atom karbon mengadakan ikatan kovalen dengan empat atom hidrogen. Dalam senyawa CH4 semua ikatan yang terjadi identik, sudut ikatan antara dua ikatan ialah 109,5° dengan bentuk geometri molekul tetrahedral (bidang empat).
Atom karbon C sanggup mengikat 4 atom H menjadi CH4 , maka 1 elektron dari orbital 2s dipromosikan ke orbital 2pz, sehingga konfigurasi elektron atom C menjadi 1s1 2s1 1px1 1py1 1pz1 . Orbital 2s mempunyai bentuk yang berbeda dengan ketiga orbital 2p, akan tetapi ternyata kedudukan keempat ikatan C-H dalam CH 4 ialah sama. Hal ini terjadi alasannya ialah pada ketika orbital 2s , 2px , 2py , dan 2pz mendapatkan 4 elektron dari 4 atom H, keempat orbital ini berubah bentuknya sedemikian sehingga mempunyai kedudukan yang sama. Peristiwa ini disebut hibridisasi. Dalam senyawa CH 4 , orbital-orbital hasil hibridisasi merupakan adonan satu orbital 2s dan tiga orbital 2p, oleh alasannya ialah itu disebut orbital hybrid sp3 . Pada senyawa CH4 terbentuk empat orbital sp3 .

Struktur tetrahedral senyawa CH4.
Beberapa bentuk geometri ikatan sanggup kalian perhatikan dalam Tabel berikut

Beberapa bentuk geometri ikatan.
0 Response to "Penjelasan Ihwal Teori Domain Elektron"
Post a Comment